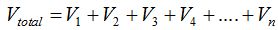Una batería o pila de limón es uno de los experimentos científicos que más se llevan a cabo en centros educativos en todo el mundo y pone de manifiesto el funcionamiento básico de una célula electroquímica. En una pila de limón la energía química se transforma en energía eléctrica.
Para llevar a cabo este experimento se necesitan varios limones, un clavo de hierro o zinc y un trozo de cobre o un elemento metálico cualquiera pero diferente del primero.
También se necesita un cable con pinzas y un polímetro que detecte la circulación de la corriente eléctrica. En el caso de no disponer de polímetro se pueden utilizar pequeñas luces LED u otros dispositivos que funcionen a bajo voltaje para comprobar que la pila de limón está generando energía eléctrica.
¿Cómo funciona una pila de limón?
Una pila de limón produce energía eléctrica gracias a la diferencia de potencial que se produce entre los dos electrodos (piezas metálicas) en los que se producen unas reacciones redox o de oxidación-reducción. El limón actúa de puente salino cerrando el circuito y favoreciendo el flujo de cargas gracias al ácido que posee (cuanto más zumo posea mejor).

En el electrodo de hierro que actúa de ánodo se produce la oxidación. Es decir, el hierro metálico pasará a la disolución como un catión y por lo tanto, el clavo de hierro se ira consumiendo a lo largo de la reacción.
Fe → Fe²⁺ – 2 e⁻ ÁNODO – OXIDACIÓN
Gracias a esta reacción se liberan electrones en el ánodo que tienden a desplazarse hacia el cátodo generando de esta forma un flujo eléctrico.
En el otro electrodo (cátodo) utilizaremos una pieza de cobre y se produciría la reducción del cobre (deberíamos de tener una disolución con cobre disuelto que iría depositándose en el cátodo como cobre metálico). En este caso no tenemos esa disolución de cobre, pero los iones que aporta el limón ayudan al flujo electrónico igualmente.
La reacción hipotética sería:
Cu²⁺ + 2 e⁻ → Cu CÁTODO – REDUCCIÓN
En nuestro caso, los electrones generados viajan por el circuito externo y llegan al electrodo de cobre, que como es un buen conductor resulta un buen lugar para que se produzca el intercambio de electrones. En la superficie del electrodo los iones hidrógeno, H+, disueltos en el zumo de limón, recogen los electrones y se forma hidrógeno gaseoso:
2 e− + 2 H+ → H2 CÁTODO – REDUCCIÓN
Al unirse estos dos metales con un cable conductor, se crea un recorrido por el que fluye la corriente eléctrica. Se puede detectar este flujo de electrones con un polímetro o algún otro dispositivo que funcione a bajo voltaje.
¿Cómo se fabrica una pila de limón?
Fabricar una pila de limón es muy sencillo, tan sólo es necesario disponer de una serie de materiales muy fáciles de conseguir, además hay muchas alternativas.
Los dos metales (electrodos) no deben entrar en contacto directo, ya que si se tocan se cerraría el circuito y se produciría descarga eléctrica.

¿Qué materiales utilizo para la pila de limón?
Los materiales a utilizar son los siguientes:
- Clavos grandes de hierro (la mayoría están recubiertos de cinc).
- Piezas de cobre.
- Cables de cobre pelados.
- Pinzas dentadas (opcional).
- Un polímetro o voltímetro que compruebe la corriente (opcional).
- Unas luces LED para comprobar visualmente el funcionamiento de la pila de limón.
¿Cómo puedo aumentar el voltaje de la pila de limón?
La realidad es que la pila de limón (con 1 limón) apenas es capaz de generar 0.50 v lo cual no nos serviría para encender la mayoría de aparatos electrónicos domésticos pero hay una sencilla solución.
Se pueden conectar varios limones en serie (la salida de uno es la entrada del siguiente) y de esta forma el voltaje total será la suma de cada una de las pilas en la serie.
Es decir si queremos encender una luz LED con 3 voltios simplemente tendremos que conectar 6 limones en serie.
Otra de las formas de aumentar el voltaje consiste en cambiar el material de los electrodos, por ejemplo, magnesio. Al producirse una reacción química diferente y puede que la diferencia de potencial entre ellos sea mayor y por tanto la pila sea más eficiente energéticamente.

Como curiosidad cabe destacar que Saiful Islam y su equipo de investigadores, el 13 de diciembre de 2016 generaron 1.275 voltios con una pila compuesta por 2.106 mitades de limón en la de la Royal Institution de Londres, Reino Unido.
TAL VEZ TE INTERESE…

¿Qué es NaK? La aleación de Sodio y Potasio

¿Qué es el Europio?

¿Qué es el punto triple del agua?

¿Por qué se congela el agua?

CALIFORNIO 252: EL METAL CON EL PRECIO MÁS CARO DEL MUNDO

¿Qué es la pátina de cobre?

¿QUÉ ES EL ÁCIDO SULFÚRICO? PROPIEDADES, BENEFICIOS Y PRECAUCIONES del H2SO4

La más rara de las tierras raras: EL PROMETIO

Estructuras Cristalinas Representativas